Caractéristiques cliniques de l’atteinte respiratoire
Introduction
La pandémie de Covid-19 monopolise les systèmes de santé du monde entier depuis plus de 18 mois. Dans la phase aiguë, le SARS-CoV-2 atteint principalement le système respiratoire, avec une prévalence de cas sévères d’environ 20 %.1,2 Ceux-ci présentent le plus souvent une insuffisance respiratoire aiguë, causée par une pneumonie bilatérale, pouvant dans certains cas se compliquer d’un syndrome de détresse respiratoire aiguë (SDRA). L’atteinte respiratoire aiguë est désormais bien documentée. Son évolution, influencée par de nombreux facteurs, est hétérogène et difficilement prédictible. L’âge, les comorbidités et l’état général au moment de l’infection influencent significativement le pronostic.3
Aujourd’hui, les séquelles respiratoires commencent à être mieux connues grâce aux données de plusieurs cohortes prospectives.4,5 Cet article traite de l’impact d’une infection due au SARS-CoV-2 sur les symptômes et les explorations fonctionnelles respiratoires, à moyen et long termes. L’évolution radiologique sera également détaillée. Finalement, il donne un aperçu de la prise en charge au cours de la période postaiguë (tableau 1 pour la définition du Covid postaigu), selon les recommandations actuelles.
Présentation clinique
Le Covid-19 respiratoire symptomatique subaigu est caractérisé par de multiples symptômes respiratoires non spécifiques et hétérogènes. Dans les 90 jours suivant l’infection, les patients d’une cohorte coréenne étaient nombreux à présenter une oppression thoracique à l’effort (62 %), de la toux (60 %), ainsi que des expectorations (43 %).7 Des études prospectives démontrent une prévalence de la dyspnée de 45, 43 et 39 % à 35, 60 et 90 jours respectivement, après l’hospitalisation chez des patients atteints principalement de formes légères ou modérées de la maladie (selon critères OMS).4,8,9 Une étude rétrospective sur une base de données américaine montre une utilisation importante de bronchodilatateurs et antitussifs à plus d’un mois du début de l’infection.10
Dans le syndrome post-Covid-19, les symptômes systémiques non respiratoires ont également une prévalence importante. La fatigue et la faiblesse musculaire étaient présentes chez 52 % des survivants à 6 mois dans la cohorte de Wuhan, les troubles du sommeil chez 27 %, l’anxiété et la dépression chez 23 %. La dyspnée était moins prévalente que durant la phase subaiguë mais persistait chez environ un tiers des patients, sans résolution dans le temps : 26 % à 6 mois et 30 % à 12 mois. Les patients atteints de forme grave sont plus à risque de présenter une dyspnée chronique. L’âge, le sexe féminin et les comorbidités sont aussi associés à un risque plus élevé de présenter des signes et des symptômes chroniques.11 D’autres études viennent confirmer ces constats avec une atteinte de la qualité de vie retrouvée chez 72 % des individus.12,13 À 6 mois, le pourcentage de patients chez qui une oxygénothérapie doit être instaurée à domicile est de 9 % selon une étude américaine.5
Le Covid-19 a d’importantes répercussions professionnelles : 12 % des patients actifs professionnellement avant la maladie ne reprennent pas leur activité après 1 an, en raison d’une limitation physique au premier plan. Parmi ceux reprenant le travail, 24 % doivent réduire leur taux d’occupation.11
Explorations fonctionnelles respiratoires
Plusieurs travaux démontrent l’impact du Covid-19 sur les fonctions pulmonaires à moyen terme. Des valeurs altérées, définies comme < 80 % de la valeur prédite, sont retrouvées pour les paramètres de pléthysmographie (capacité pulmonaire totale (CPT)), spirométrie (volume expiratoire maximal par seconde (VEMS), capacité vitale forcée (CVF)) et surtout pour la capacité de diffusion du monoxyde de carbone (DLCO). Une étude rétrospective a montré, 1 mois après la sortie d’hospitalisation des patients atteints en majorité de formes légères à modérées, des valeurs anormales de DLCO (53 % des patients), CPT (44 %), CVF (12 %) et VEMS (10,5 %).14
L’altération de la DLCO est le facteur présentant la plus forte association avec la sévérité de l’atteinte initiale.15 Après 4 mois, une diminution de la DLCO de 21 % en valeur prédite est observée chez les patients avec Covid-19 sévère par rapport à ceux ayant eu une infection légère à modérée.16 Bellan et coll. ont montré qu’environ la moitié des patients hospitalisés (72 % avec oxygénothérapie, ventilation non invasive (VNI) ou intubation) avaient une diminution persistante de la DLCO après 3 mois, dont 15 % avec une altération d’importance moyenne à sévère (DLCO < 60 %).17 Une association est retrouvée entre le trouble de la DLCO et la sévérité de la dyspnée résiduelle.18 Cette atteinte de la capacité de diffusion liée au SARS-CoV-2 est similaire à celle provoquée par les virus SARS-CoV et MERS-CoV, qui provoquent une altération de la DLCO dans 24 % des cas à 6 mois.19
Dans une étude canadienne, le suivi à 4 mois a montré que 45 % des patients avaient une CPT altérée, témoignant d’un syndrome restrictif, alors qu’un trouble obstructif (VEMS/CVF < 0,7) était constaté chez seulement 11 % des patients.18 Une hyperréactivité bronchique confirmée par test à la métacholine a été mise en évidence chez 4 % des patients, résolutive après 2 mois de traitement par bronchodilatateurs incluant un corticostéroïde inhalé.20
Les facteurs associés à une altération des fonctions pulmonaires sont multiples : ventilation mécanique, durées de la ventilation et de l’hospitalisation, comorbidités, BPCO, tabagisme et obésité.20 De manière remarquable, une étude a montré des résultats de fonctions pulmonaires inversement proportionnels au taux d’IgG anti-SARS-CoV-2 mesuré en parallèle, suggérant une corrélation avec l’intensité de l’inflammation initiale.20 Une administration de corticostéroïdes durant la phase aiguë est en revanche associée à de meilleures valeurs de fonctions pulmonaires à 3 mois de l’infection.17,21
En plus de l’atteinte du parenchyme pulmonaire, il existe aussi des données sur l’atteinte des muscles respiratoires après une infection à SARS-CoV-2. En raison du faible nombre de patients étudiés, celles-ci sont à interpréter de manière prudente. Des valeurs de pressions inspiratoires et expiratoires maximales diminuées ont ainsi été documentées chez plus de la moitié des participants à une étude chinoise, 30 jours après la sortie d’hôpital.14 Une étude italienne a montré la persistance de ces anomalies à 4 mois chez des patients avec Covid-19,22 tandis qu’elles n’étaient plus présentes dans une cohorte suisse de patients atteints en majorité de formes sévères à 4 mois de l’infection initiale.15
Une désaturation avec SpO₂ < 88 % est retrouvée lors du test de marche de 6 minutes (TM6M) chez 7 % des patients 3 mois après leur hospitalisation.18 Une diminution de la PaO₂ de plus de 3 mmHg lors de l’ergospirométrie (CPET) réalisée à 4 mois de suivi, proportionnelle à la sévérité de l’atteinte initiale, suggère un rôle prépondérant de l’altération des échanges gazeux dans la limitation de la capacité d’effort.20 Une diminution de la VO₂ max est constatée lors d’une ergospirométrie avec mesures invasives (iCPET), en lien avec une extraction périphérique en oxygène altérée ainsi qu’une réponse ventilatoire augmentée durant l’effort.23 Une autre étude souligne le rôle du déconditionnement musculaire dans la limitation de la capacité d’effort.24
Imagerie thoracique
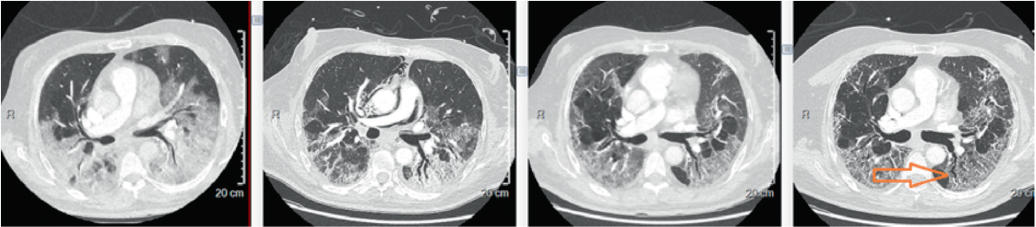
Au suivi à 3 mois de patients ayant été hospitalisés, la prévalence des anomalies scanographiques varie entre 42 et 71 %.25,26 Les plus fréquemment retrouvées sont les infiltrats en verre dépoli. D’autres anomalies sont observées, notamment les consolidations et des infiltrats en bande.13,26,27 Les remaniements fibrotiques, tels que réticulations, rayons de miel et bronchiectasies, sont également présents à plus de 3 mois de l’hospitalisation dans 26 % des cas et jusqu’à 63 % en cas de SDRA (figure 1).13,28 Dans une étude observationnelle prospective suisse, Guler et coll. ont montré que la sévérité de l’infection initiale est corrélée à la présence d’hypoatténuation en mosaïque au CT-scan (figure 2). Celle-ci pourrait être le témoin d’une atteinte des petites voies aériennes ou d’une altération de la membrane alvéolo-capillaire. Des pneumatocèles, pouvant se compliquer de pneumothorax en cas de rupture, sont également retrouvées.15,29
Les facteurs de risque associés à la présence d’anomalies scanographiques persistantes sont la durée d’hospitalisation, l’admission aux soins intensifs, les comorbidités ou encore les paramètres inflammatoires initiaux (leucocytose).26 L’étendue de l’atteinte initiale constatée à l’imagerie est déterminante pour l’évolution à long terme. Un CT-score élevé, calculé sur la base du nombre et de la proportion de lobes atteints, est ainsi associé à une plus haute prévalence de remaniements fibrotiques à 6 mois.28,30 La présence d’anomalies scanographiques est également associée négativement à la valeur de DLCO13 ainsi qu’à une désaturation au TM6M.31 Elle n’est néanmoins pas corrélée significativement à la présence de symptômes.26
L’ultrasonographie est un outil non irradiant et peu coûteux qui permet de détecter et suivre des séquelles au niveau du parenchyme pulmonaire, sous forme d’atteinte interstitielle. Des lignes B sont visualisées chez 25 % des patients entre 3 et 6 mois posthospitalisation.32
Physiopathologie
Les mécanismes physiopathologiques précis à l’origine des séquelles respiratoires de l’infection à SARS-CoV-2 ne sont pas complètement élucidés. Les lésions du parenchyme pulmonaire pendant la phase aiguë de l’infection impliquent des mécanismes liés directement au virus, c’est-à-dire l’invasion de l’épithélium alvéolaire et de l’endothélium vasculaire par le SARS-CoV-2, ainsi que des mécanismes indirects, liés à un processus inflammatoire avec un profil cytokinique spécifique.33 Ces phénomènes entraînent une rupture de la barrière alvéolo-capillaire, avec un envahissement de monocytes et neutrophiles, ainsi qu’une extravasation d’exsudat dans l’espace alvéolaire qui conduit à un œdème lésionnel, dans un processus similaire aux autres formes de SDRA.34 Dans certains cas, un processus fibrotique apparaît déjà pendant la phase aiguë, avec une prolifération myofibroblastique associée à une fibrose murale et un rayon de miel microkystique, conformes à la phase fibrotique du dommage alvéolaire diffus (DAD) dans le SDRA classique.35,36 Ce processus fibrotique peut continuer à se développer de manière indépendante après la phase infectieuse aiguë en l’absence d’éléments viraux.37 Des analyses du tissu pulmonaire post mortem ont montré des dommages alvéolaires favorisés par des cytokines telles que l’interleukine-6 (IL-6) et le facteur de croissance transformant-b (TGF-b), connues pour être impliquées dans la pathogenèse de la fibrose pulmonaire.38
Une atteinte microthrombotique des capillaires alvéolaires est aussi observée dans les études histopathologiques. La combinaison de ces différents mécanismes pourrait expliquer l’altération prédominante de la DLCO précédemment discutée.39,40 Un processus inflammatoire, parfois retardé, peut également se produire sous forme de pneumonie organisée (OP) ou de pneumonie organisée fibrineuse aiguë (AFOP).41
Il est important de relever que l’atteinte chronique après une infection à SARS-CoV-2 est d’origine multifactorielle, en lien avec une atteinte parenchymateuse et/ou vasculaire pulmonaire, mais aussi avec des composantes extrapulmonaires. Il existe souvent une participation du système cardiovasculaire, des complications thromboemboliques, neurologiques, ou encore du déconditionnement. L’atteinte musculaire est associée d’une part à la faiblesse acquise aux soins intensifs et l’utilisation des bloqueurs neuromusculaires et, d’autre part, à l’utilisation prolongée des corticostéroïdes systémiques. Elle est également favorisée par l’état inflammatoire chronique ainsi que la dénutrition, et peut impacter la mécanique respiratoire.42
Prise en charge et suivi pneumologique après une infection à sars-cov-2
À l’heure actuelle, il est difficile de prédire avec certitude quel patient développera une atteinte respiratoire chronique suite à une infection à SARS-CoV-2. La prévalence élevée de séquelles respiratoires chroniques, observée lors des épidémies précédentes dues aux virus de la grippe H1N1, SARS-CoV et MERS-CoV, souligne l’importance d’un suivi rapproché des patients après une infection à SARS-CoV-2. Suite aux résultats des premières études observationnelles, des recommandations concernant l’indication et les modalités d’un suivi pneumologique de cette population ont été publiées par les différentes sociétés savantes pour le Covid-19 postaigu (tableau 2).6,43-47
Dépistage
Une première évaluation de la présence et de la cinétique des symptômes respiratoires peut être effectuée par le médecin de premier recours chez tout patient 1 à 3 mois après l’infection à SARS-CoV-2. Une quantification de la dyspnée et de son impact sur les activités de la vie quotidienne à l’aide des échelles habituellement utilisées (NYHA, échelle de dyspnée modifiée du Medical Research Council (mMRC)) est recommandée. Il est également préconisé de compléter l’anamnèse par un examen clinique et une mesure de la SpO₂ au repos, et si possible à l’effort, à la recherche d’une hypoxémie.6,43 Un suivi pneumologique sera indiqué en fonction des résultats de cette évaluation, en parallèle avec des investigations complémentaires pour exclure des causes alternatives à la dyspnée et l’hypoxémie.
Évaluation fonctionnelle pulmonaire
La Société suisse de pneumologie (SSP) a récemment publié les recommandations suisses pour le suivi pneumologique et le traitement des séquelles respiratoires du Covid-19 élaborées par un groupe d’experts,6 puis soumises selon la méthode CORE48 à un panel composé de 40 pneumologues pour la première enquête et 22 pour la deuxième, qui a eu lieu 3 mois plus tard.
En ce qui concerne les patients qui ont nécessité une hospitalisation pour une infection à SARS-CoV-2, il existe une recommandation forte en faveur d’une évaluation et d’un suivi pneumologique. Le bilan devrait comprendre, hormis une anamnèse détaillée à la recherche de symptômes respiratoires, la réalisation d’une spirométrie, complétée par une pléthysmographie et une mesure de la DLCO en cas d’anomalie décelée. Une gazométrie artérielle est indiquée chez les patients hypoxémiques, c’est-à-dire avec une SpO₂ au repos < 92 %, présentant une désaturation (SpO₂ < 90 %) à l’effort, ou ceux nécessitant une oxygénothérapie à domicile. En l’absence de consensus sur le délai de ce bilan, celui-ci peut être effectué entre 1 et 3 mois après le diagnostic initial.
L’indication à un bilan et un suivi pneumologique est également retenue (recommandation forte) pour les patients avec persistance de symptômes respiratoires indépendamment de la sévérité de l’atteinte respiratoire initiale due au SARS-CoV-2. En cas de symptômes évocateurs d’un asthme, les investigations peuvent être complétées par un test de provocation à la recherche d’une hyperréactivité bronchique. Le risque de transmission au personnel réalisant les tests est faible si cet examen est réalisé à distance de l’épisode aigu (au-delà de 3 mois).
Des fonctions pulmonaires complètes et une analyse des gaz du sang sont proposées de routine pour les patients avec antécédents d’infection sévère à SARS-CoV-2 (défini selon les critères de l’OMS),16 indépendamment de la présence ou non de symptômes respiratoires. Cette recommandation est basée sur l’évidence désormais bien documentée de l’association entre une maladie respiratoire initiale sévère et des complications fonctionnelles et ventilatoires à long terme qui nécessiteront potentiellement un traitement spécifique.5,49,50
Les recommandations suisses pour les séquelles respiratoires du Covid-19 peuvent diverger dans les détails de celles publiées par des sociétés savantes d’autres pays, mais le dénominateur commun est de maintenir un seuil bas d’investigation des symptômes respiratoires prolongés après la phase aiguë de l’infection.
Évaluation de la capacité d’effort
L’évaluation de la capacité à l’effort, par exemple à l’aide d’un TM6M avec mesure de la SpO₂, doit être réalisée chez tous les patients avec antécédents d’infection sévère à SARS-CoV-2 et d’hospitalisation, ainsi que chez les patients symptomatiques indépendamment de la sévérité de l’atteinte initiale. L’examen permettra de détecter une hypoxémie à l’effort et, en conjonction avec la gazométrie, d’établir l’indication à une oxygénothérapie. Pour les patients avec des difficultés de mobilisation, des tests alternatifs, comme le test du lever de chaise sur 1 minute (TLC1),51 sont proposés. En fonction des résultats du TM6M et des fonctions pulmonaires (notamment de la mesure de la DLCO), le bilan pourra être complété par une ergospirométrie pour mieux évaluer l’adaptation ventilatoire et cardiovasculaire à l’exercice. Cet examen fournira également des informations précieuses concernant l’évaluation de la capacité au travail des patients qui présentent des séquelles respiratoires chroniques liées au Covid-19.
Imagerie
Les données actuellement disponibles sur la prévalence d’une atteinte interstitielle compatible avec un processus fibrotique secondaire à l’infection par le SARS-CoV-2 sont dérivées d’études avec un suivi de 6 à 12 mois au maximum et ne permettent pas de prédire avec certitude si les lésions fibrotiques observées sont réellement irréversibles. De plus, l’évolution des autres altérations radiologiques décrites, telles que les infiltrats en verre dépoli ou les hypoatténuation en mosaïque, n’est pas encore connue. Dans ce contexte, la SSP recommande un suivi radiologique par CT-scan thoracique pour les patients avec des fonctions pulmonaires anormales, lors de persistance de symptômes respiratoires, ainsi que pour le suivi des anomalies présentes au CT-scan initial. L’intervalle du suivi radiologique n’est pas clairement défini ; des CT-scan semestriels pendant les premiers 12 à 18 mois sont généralement proposés.52 Le tableau 2 résume les recommandations actuelles pour le suivi pneumologique après une infection à SARS-CoV-2.
Autres investigations
Dyspnée
Avant ou parallèlement aux investigations fonctionnelles et radiologiques, il est recommandé de rechercher et d’exclure les autres causes de dyspnée potentielles, telles qu’une anémie, une maladie cardiovasculaire, un déconditionnement ou une atteinte des muscles respiratoires.
Atteinte cardiovasculaire
En dehors des complications cardiaques directement liées au SARS-CoV-2, comme la myocardite inflammatoire dans le contexte de l’infection virale, une échocardiographie doit être effectuée pour investiguer une dyspnée persistante.43 L’examen est notamment utile pour détecter une hypertension pulmonaire, qui peut accompagner par exemple une atteinte interstitielle sévère se manifestant par une hypoxémie et des troubles de la diffusion du CO. Par ailleurs, en cas d’antécédent d’embolie pulmonaire durant la phase aiguë ou de suspicion d’une atteinte vasculaire pulmonaire (maladie thromboembolique chronique), il est recommandé de compléter les investigations par une scintigraphie de ventilation-perfusion et éventuellement une angiographie par CT.3
Atteinte des muscles respiratoires
En cas de persistance d’une dyspnée et/ou en présence d’une insuffisance respiratoire (hypoxémique ou globale), il est préconisé d’exclure une atteinte des muscles respiratoires, notamment chez les patients qui ont nécessité une ventilation mécanique invasive prolongée.43 Dans ce contexte, il est proposé d’effectuer une mesure des pressions respiratoires maximales ainsi que de la capacité vitale en position assise et couchée. En cas d’anomalie ou de haute suspicion d’une atteinte diaphragmatique, le bilan pourra être complété par une imagerie (ultrason et scopie du diaphragme ou IRM diaphragmatique) ou une stimulation magnétique des nerfs phréniques.53 Des examens fonctionnels, tels qu’une capnoxymétrie nocturne, éventuellement combinée par une poly(somno)graphie nocturne, pourront être proposés si l’atteinte neuromusculaire est confirmée.
Toux persistante
En cas de toux persistante au-delà de 3 mois après l’infection initiale et en absence d’argument radiologique et/ou fonctionnel en faveur d’une origine pulmonaire (y compris une hyperréactivité bronchique), il est proposé d’exclure les causes classiques d’une toux chronique par un bilan ORL (notamment si antécédent d’intubation orotrachéale) ainsi que la recherche d’un reflux gastro-œsophagien.43,54
Centres spécialisés Covid-19
Le Covid-19 est une maladie multisystémique avec des manifestations variées, dont certaines persistent durant la phase postaiguë et au-delà. Dans ce contexte, une prise en charge multidisciplinaire est recommandée. Une telle prise en charge permettra une évaluation plus holistique des patients, une priorisation des populations à plus haut risque de complications et une continuité du suivi. Parallèlement, l’établissement de cohortes prospectives contribuera à une meilleure compréhension du Covid postaigu dans un but d’améliorer la prise en charge des patients, leur état de santé et leur qualité de vie à long terme après une infection à SARS-CoV-2.3,55
Prise en charge et traitement de l’atteinte pulmonaire
Réhabilitation
La pierre angulaire de la prise en charge des symptômes respiratoires post-SDRA, y compris dans le contexte du SDRA postinfection à SARS-CoV-2, reste la réhabilitation pulmonaire, axée non seulement sur le réentraînement à l’effort, mais aussi sur la rééducation et des approches comportementales, dans un but d’améliorer la condition physique et mentale des personnes avec des symptômes respiratoires chroniques. Les résultats émergents sont encourageants56,57 et de multiples études cliniques sont en cours, y compris en Suisse (NCT04881214, NCT04896905), afin de mieux évaluer le bénéfice de la réhabilitation pulmonaire à long terme après une infection à SARS-CoV-2.3 Une étude prospective randomisée et contrôlée en Chine a montré que les bénéfices de la réhabilitation pulmonaire, quand elle est associée à des interventions psychologiques, peuvent s’étendre au-delà de la fonction pulmonaire et de la capacité à l’effort, sur la qualité de vie et l’anxiété.58
La participation à un programme de réhabilitation (ambulatoire ou stationnaire) doit être proposée à toute personne qui reste symptomatique suite à une infection à SARS-CoV-2.6,43,47 Une première évaluation de l’indication à une réhabilitation doit être effectuée rapidement après l’épisode aigu (ou après la sortie de l’hôpital), soit dans les 6 à 8 semaines.47
Corticostéroïdes inhalés
Pour les patients avec une maladie respiratoire préexistante traitée par corticostéroïde inhalé (CSI) (par exemple, asthme, chevauchement asthme/BPCO ou autre maladie éosinophilique des voies respiratoires), il n’y a pas d’évidence concrète en faveur d’une augmentation du risque d’infection ou de mortalité par le SARS-CoV-2 en lien avec le CSI ;59 il est dès lors recommandé de poursuivre le traitement habituel pendant les phases aiguë et postaiguë de l’infection.6,43,60
Il n’y a actuellement pas de donnée sur l’effet des CSI à distance de l’épisode aigu, en présence d’une atteinte des voies aériennes nouvellement diagnostiquée ou d’une toux chronique. Toutefois, étant donné le rôle connu des CSI sur la diminution de l’inflammation bronchique, le bon profil de tolérance, et par analogie à la prise en charge d’une toux chronique ou d’une hyperréactivité bronchique postvirale, un traitement empirique par CSI peut être proposé, seul ou en combinaison avec un bronchodilatateur à longue durée d’action. Un suivi clinique et fonctionnel est indiqué après 4 à 6 semaines afin d’évaluer la réponse thérapeutique et d’arrêter le traitement en cas d’inefficacité.6,43
Corticostéroïdes systémiques
Une amélioration significative fonctionnelle, symptomatique et radiologique a été démontrée dans une cohorte prospective de patients avec atteinte interstitielle inflammatoire secondaire à une infection à SARS-CoV-2 traités par corticothérapie systémique à distance de l’épisode aigu.61 En l’absence de données dérivées d’études randomisées et contrôlées, la décision d’un traitement d’épreuve par corticostéroïdes systémiques doit être évaluée au cas par cas, notamment en présence d’une imagerie suggestive d’une OP ou d’atteinte des petites voies aériennes.6 L’indication à un lavage broncho-alvéolaire (LBA), afin d’exclure une surinfection, et à un bilan d’autoimmunité doit être également discutée avant l’introduction d’une corticothérapie.43
Antifibrotiques
Le mécanisme physiopathologique qui conduit à des séquelles fibrotiques n’est pas élucidé. Il existe toutefois un chevauchement évident entre les facteurs de risque identifiés pour une infection sévère à SARS-CoV-2 (âge, sexe masculin, comorbidités cardiovasculaires) et ceux prédisposant au développement d’une fibrose pulmonaire.62 Les médicaments actuellement disponibles pour le traitement de la fibrose pulmonaire ont démontré une activité antifibrotique qui semble être indépendante de l’étiologie de la fibrose.63,64 Ce mécanisme d’action pourrait théoriquement s’avérer utile pour le traitement des séquelles fibrotiques du Covid-19 et est en cours d’évaluation par plusieurs études cliniques (NCT04619680, NCT04541680, NCT04338802, NCT04607928, NCT04653831). En attendant ces résultats, la décision d’instaurer un traitement antifibrotique doit faire l’objet d’une évaluation au cas par cas et d’une discussion multidisciplinaire.
Transplantation pulmonaire
Pour les patients avec fibrose pulmonaire idiopathique, la transplantation pulmonaire reste la seule intervention associée à une diminution de la mortalité. En revanche, en ce qui concerne les séquelles pulmonaires fibrotiques secondaires à une pneumonie à SARS-CoV-2, l’adoption de cette approche est limitée par certains aspects tels que l’évolutivité de la fibrose, le potentiel de récupération du parenchyme pulmonaire sous ECMO (Extracorporeal Membrane Oxygenation) prolongée, les complications infectieuses, le risque de réactivation virale et le déconditionnement sévère qui accompagne très souvent les candidats potentiels.
Des cas sélectionnés de SDRA sévère secondaire à une infection à SARS-CoV-2, qui ont bénéficié d’une transplantation bipulmonaire, ont été rapportés dans la littérature37,65-68 avec des résultats jusqu’à maintenant encourageants. Toutefois, plusieurs facteurs influencent la survie et la qualité de vie post-transplantation. Une sélection rigoureuse des candidats est primordiale, avec des critères reposant sur l’âge (< 65 ans), le consentement du patient, l’absence de dysfonction d’autres organes et de contre-indication à une transplantation, la présence d’une atteinte interstitielle sévère et irréversible (dont le potentiel de récupération a été évalué après un laps de temps suffisant), la négativité de la PCR pour le SARS-CoV-2 et la capacité de participer à une réhabilitation pendant la période en liste de transplantation. Il va de soi qu’une transplantation pour un SDRA post-Covid-19 doit être réalisée dans des centres possédant une expertise suffisante, et en tenant compte de la situation de la liste d’attente régionale, afin d’assurer une allocation d’organes équitable aux patients avec les meilleures chances de survie.69
Conclusion
L’atteinte aiguë due au SARS-CoV-2 est multiorganique, avec un impact majeur sur le système respiratoire. Des symptômes respiratoires peuvent persister plusieurs mois après l’infection initiale, avec une répercussion possible sur la qualité de vie. Les séquelles sur le parenchyme pulmonaire, causées par la destruction des parois alvéolaires et parfois par un processus-fibrotique, sont associées à des anomalies des fonctions pulmonaires et du CT-scan thoracique.
La prise en charge des patients atteints du Covid-19 doit se poursuivre bien au-delà de l’infection aiguë et de la sortie d’hospitalisation. Plusieurs sociétés savantes ont émis des recommandations de prise en charge, incluant un dépistage par le médecin de premier recours ainsi que des examens paracliniques dédiés. La réhabilitation pulmonaire a une place centrale dans la récupération de la capacité d’effort, surtout après une forme sévère. La place des traitements spécifiques des atteintes pulmonaires, notamment les corticostéroïdes, les antifibrotiques et la transplantation pulmonaire, reste encore incertaine. Des travaux supplémentaires sont nécessaires afin de déterminer leur utilité et leur efficacité. Après le début d’une quatrième vague en Europe, il est essentiel d’offrir aux patients victimes de séquelles du Covid-19 une prise en charge multidisciplinaire optimale, en adéquation avec les ressources disponibles du système de santé.
Conflit d’intérêts :
Les auteurs n’ont déclaré aucun conflit d’intérêts en relation avec cet article.
Remerciements :
Les auteurs remercient la Pre Paola Gasche-Soccal pour sa relecture du manuscrit.
Implications pratiques
• Les symptômes respiratoires après une infection à SARS-CoV-2 peuvent persister pendant plusieurs mois après l’épisode aigu
• L’infection peut être associée à des anomalies persistantes des fonctions pulmonaires (atteinte prédominante de la capacité de diffusion du monoxyde de carbone) et du CT-scan thoracique
• Une première évaluation, comprenant une anamnèse respiratoire, un examen clinique et une mesure de la SpO2 au repos (et si possible à l’effort), peut être effectuée par le médecin de premier recours chez tout patient 1 à 3 mois après l’infection
• Un suivi pneumologique comprenant des fonctions pulmonaires, une évaluation de la capacité à l’effort et une imagerie est indiqué pour les patients qui restent symptomatiques et ceux qui ont nécessité une hospitalisation
• Une réhabilitation pulmonaire est indiquée en cas de persistance des symptômes ou suite à une infection sévère. Les traitements spécifiques (corticostéroïdes, antifibrotiques, transplantation pulmonaire) doivent être évalués au cas par cas